
Investigadores del CNIO han logrado por primera vez incrementar en un 14 % la vida de ratones sin alterar su ADN y los roedores también son más sanos y delgados
05 nov 2019 . Actualizado a las 19:26 h.¿Es posible alargar la vida sin ninguna modificación genética en el ADN? No. Ni ahora mismo tampoco es seguro el uso de la edición genética para eliminar enfermedades que nos permitan prolongar la vida. Pero quizás dentro de un tiempo la respuesta sea otra gracias a una investigación del Centro Nacional de Investigaciones Oncológicas (CNIO) en la que han conseguido aumentar en un 13 % la longevidad de los ratones estudiados. No es este, sin embargo, el hecho más significativo, sino que lo han logrado alargando los telomeros, una especie de caparazón que se encuentra en el extremo de los crosomas, en el núcleo de cada célula del cuerpo. O, lo que es lo mismo, se ha aumentado la esperanza de vida en un animal sin alterar sus genes.
«Este resultado apoya la idea de que, a la hora de determinar la longevidad, los genes no son lo más importante», explica María Blasco, jefa del Grupo de Telomeros y Telomerasa del CNIO y autora intelectual del trabajo, que se ha publicado en la revista científica Nature Communications. Los roedores analizados no solo viven más, sino también mejor. Con mejor salud, sin cáncer, ni obesidad.
La función de los telomeros es proteger la integridad de la información genética contenida en el ADN. Cada vez que las células se dividen, en un proceso constante, se acortan un poco, por lo que una de las principales características fisiológicas del envejecimiento es la acumulación de telomeros cortos en las células. «Bastan los telomeros cortos para provocar el envejecimiento del organismo y reducir la duración de la vida», se explica en el estudio.

El objetivo, entonces, pasa por evitar este recorte. Que puede ser posible ya es algo que el equipo de María Blasco, que también es la directora del CNIO, había observado en trabajos precedentes. Mediante la activación de la enzima alargadora de los extremos de los cromosomas, la telomerasa, se conseguía prolongar la longevidad sin efectos secundarios.
Pero hasta ahora todas las intervenciones sobre la longitud de los telomeros, según explica el CNIO, se han basado en alterar la expresión de los genes, mediante una u otra técnica. De hecho, el equipo español desarrolló hace unos años una terapia génica que promueve la síntesis de la telomerasa, con la que obtuvo ratones que viven un 24 % más sin desarrollar cáncer ni otras enfermedades asociadas a la edad.
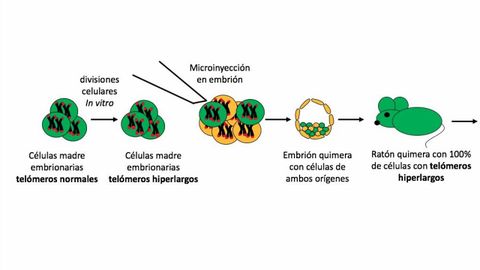
La novedad en este caso es que en los ratones nacidos con telomeros hiperlargos no ha habido ninguna alteración genética. En el 2009, los investigadores trabajaban con las llamadas células IPS ?células de un organismo adulto a las que se ha devuelto la pluripotencia o capacidad de generar un organismo completo?, y observaron que tras un cierto número de divisiones en placas de cultivo estas células adquirían telómeros el doble de largos de lo habitual. Intrigados, confirmaron que lo mismo ocurría en células embrionarias normales ?también pluripotentes?, al ser mantenidas en cultivo tras extraerlas del blastocisto.
Al investigar el fenómeno hallaron que durante el estadio de pluripotencia hay determinadas marcas bioquímicas en los telómeros que facilitan su alargamiento, por parte de la enzima telomerasa. Por eso en las células pluripotentes en cultivo los telómeros se alargaban hasta el doble de lo normal. ¿Podían las células embrionarias con telómeros hiperlargos dar lugar a ratones vivos? Hace unos años el grupo demostró que sí. Pero estos primeros animales eran quiméricos, es decir, solo parte de sus células «entre el 30 % y el 70 %» procedían de las células embrionarias con telómeros hiperlargos. Su buena salud podría atribuirse al funcionamiento correcto del resto de las células, con telómeros normales.
En el trabajo que ahora se publica los autores han logrado que el 100 % de las células de los ratones tengan telómeros hiperlargos, con lo que todo rasgo peculiar es atribuible a este fenómeno.
Menos cáncer y más delgados
«Estos ratones tienen menos cáncer y son más longevos», describen los autores. «Un hecho importante es que son más delgados de lo normal porque acumulan menos grasa. También muestran un menor envejecimiento metabólico, con niveles más bajos de colesterol y LDL (grasa mala), y una mejor tolerancia a la insulina y la glucosa. El daño en su ADN a medida que envejecen es menor y tienen una mejor función de sus mitocondrias, otro de los talones de Aquiles del envejecimiento».
En conclusión, «estos resultados sin precedentes demuestran que los telómeros más largos de lo normal en una especie dada no son perniciosos, sino más bien lo contrario: tienen efectos beneficiosos, como una mayor longevidad, retraso en la edad metabólica y menos cáncer», aseguran los autore de la investigación..
Son relevantes también las alteraciones metabólicas observadas, porque es la primera vez que se encuentra una relación clara entre longitud de los telómeros y metabolismo. La ruta genética del metabolismo de la insulina y la glucosa es una de las identificadas como más importantes en relación al envejecimiento.
Pero lo que más llamativo resulta a los investigadores es que el hallazgo abre la vía a prolongar la longevidad sin cambiar los genes del organismo. La alteración bioquímica que facilita el alargamiento de los telómeros en la fase de pluripotencia es de tipo epigenético, es decir, actúa como una anotación química que modifica el trabajo de los genes, pero no los altera en su esencia.
Ha bastado «con alargar el tiempo en que las células embrionarias se mantienen en pluripotencia para generar ratones con telómeros más largos, protegidos del cáncer y de la obesidad, y más longevos», señalan los autores. «Presentamos un nuevo modelo de ratón al que se ha retrasado el envejecimiento sin manipulación genética alguna», aseguran.


