El microbioma se cuenta en millones de millones, supera en número a las células humanas y cada vez se le atribuyen más funciones como la inmunitaria
28 sep 2025 . Actualizado a las 11:11 h.Millones de microorganismos conviven en el cuerpo humano. Bacterias, hongos, arqueas y virus comparten espacio con células, de todo tipo, y forman un ecosistema de tal magnitud que puede decirse, en palabras de Ignacio López-Goñi, catedrático de Microbiología de la Universidad de Navarra, que una persona es mitad humana, mitad bacteria. «Por cada célula humana, tenemos una bacteria», adelanta el divulgador científico.
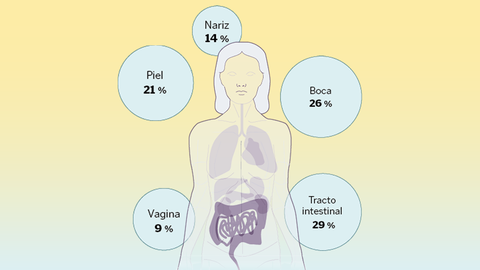
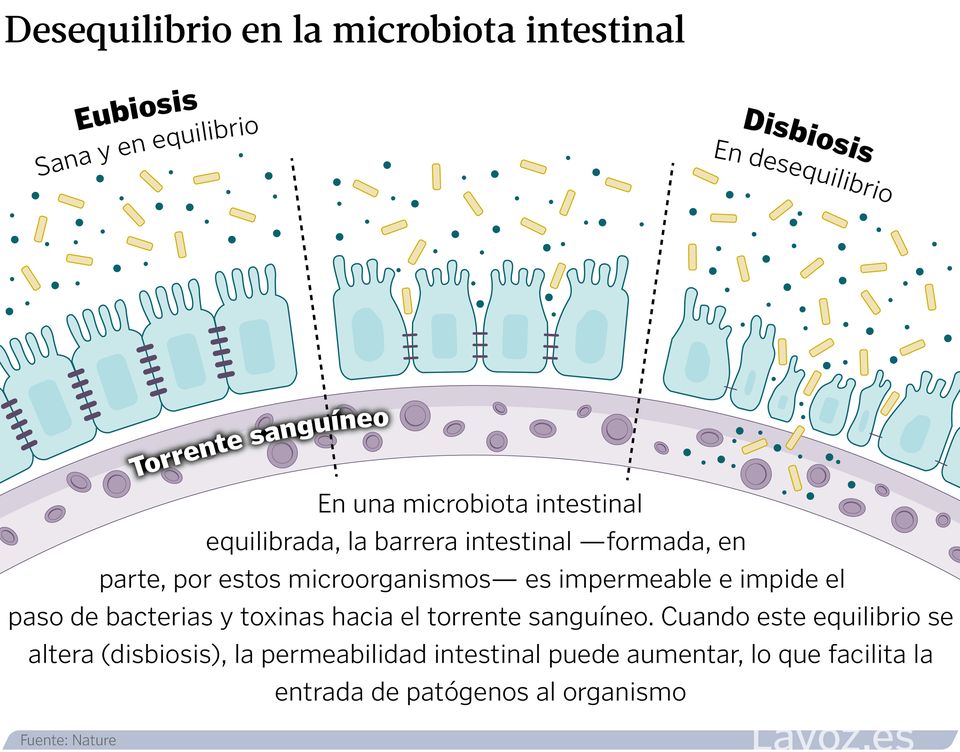
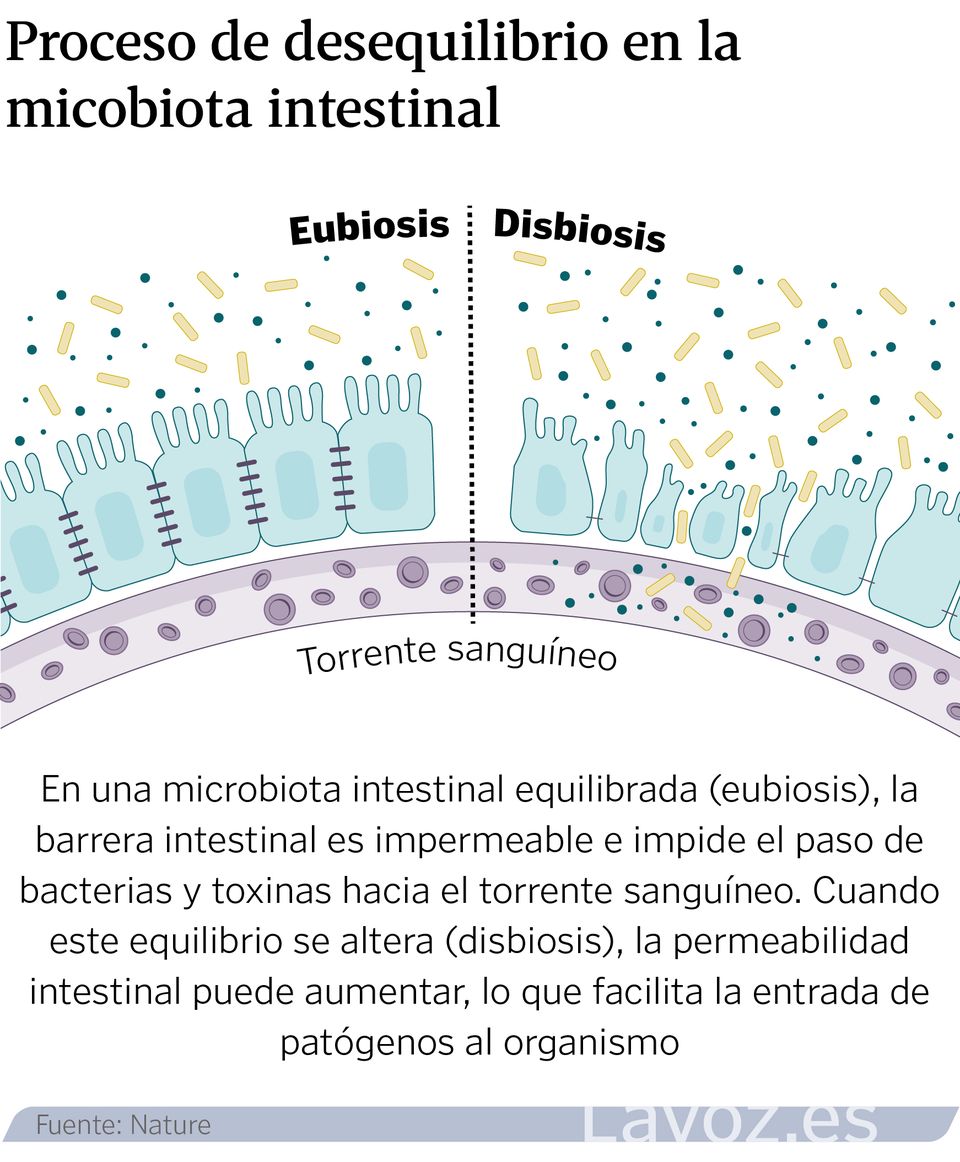
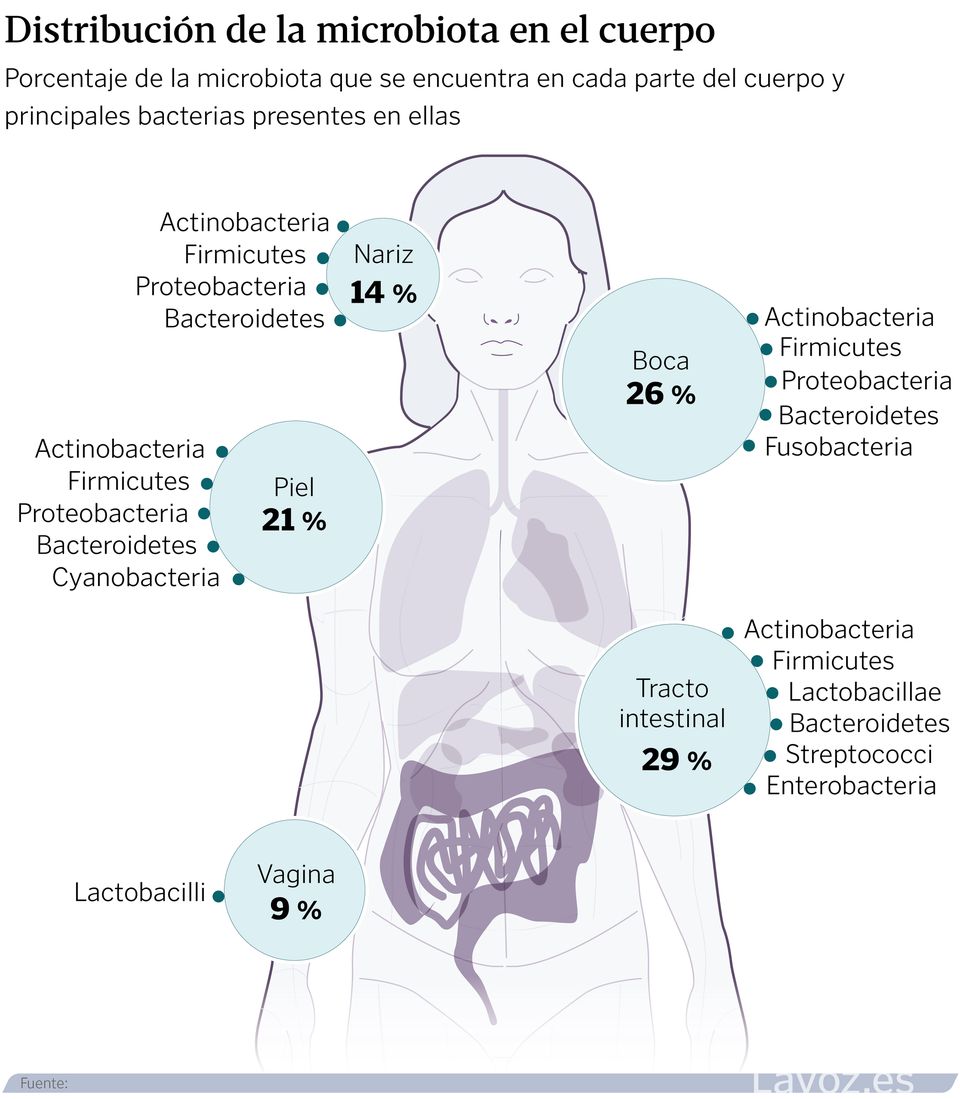
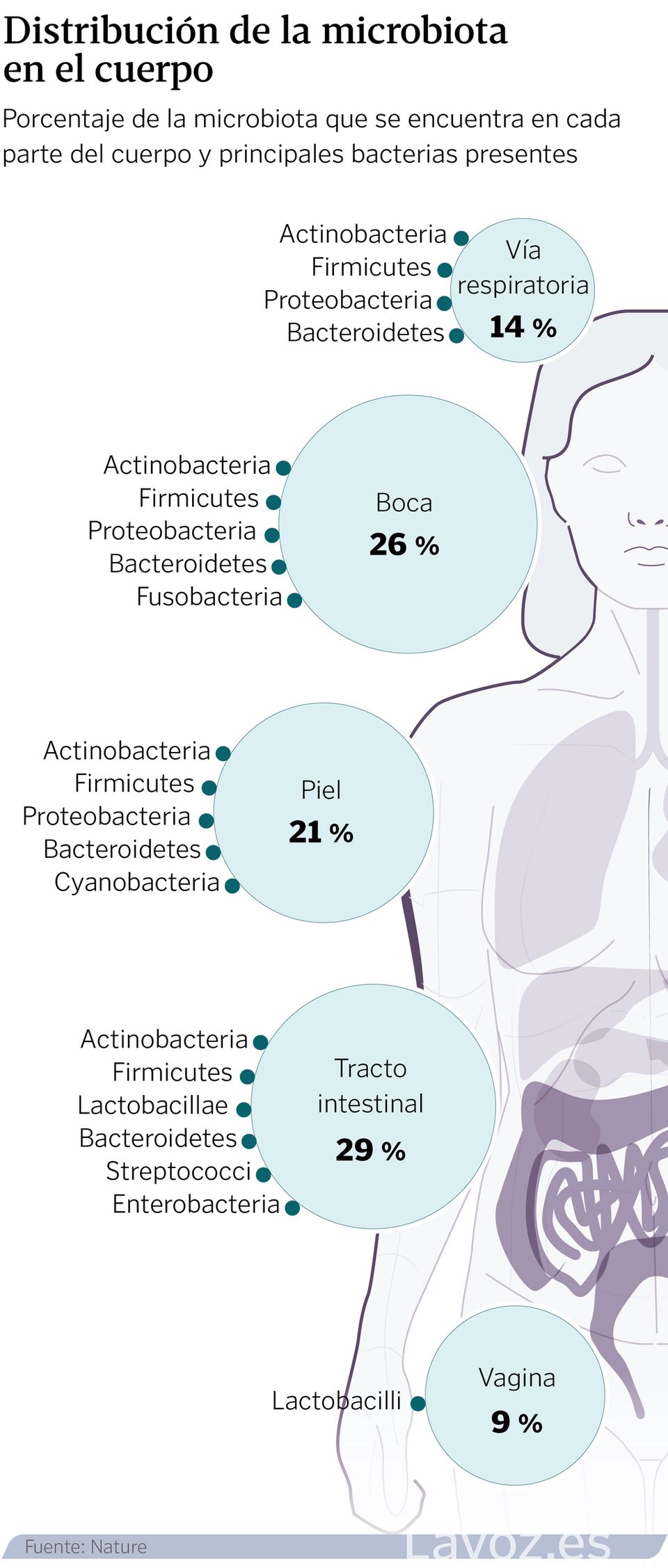
Un ecosistema que, cuando está en equilibrio permite hablar de salud. Pero cuando se altera y se produce una disbiosis, «se puede relacionar con estados de enfermedad», indica el experto. «No estamos solos», reconoce Aleix Lluansi, investigador del grupo de Enfermedades Infecciosas y Microbioma del Institut de Recerca Sant Joan de Déu. Por orden de habitantes, el intestino, la boca, la piel, los pulmones y la vejiga tienen su propio universo de patógenos, con nombre y apellidos, que crecen y evolucionan a la par que lo hace su huésped.
Suelen alojarse, especialmente, en las capas mucosas y superficiales de los tejidos, y presentan cierta capacidad para relacionarse con el medio ambiente. Se suma, además, que estas comunidades varían en cantidad dentro de una misma zona. Por ejemplo, son más abundantes en el tracto respiratorio superior que en el inferior, o en el íleon y colon que en el estómago.
También sucede lo contrario. Hay zonas donde su paso está prohibido. «La sangre es un líquido que debe ser totalmente estéril», ejemplifica María Cisneros, también investigadora del grupo de Enfermedades Infecciosas y Microbioma del Institut de Recerca Sant Joan de Déu.
El inicio
El origen de la microbiota se sitúa en el momento del nacimiento. Pese a que algunos autores apuntan al traspaso de bacterias en la placenta, la teoría aceptada hasta el momento es que la colonización se inicia en el nacimiento. El tipo de parto tiene mucho que decir en esta adquisición.
Si es vaginal, los microbios de comunidades vaginales y fecales de la madre pasan al niño para formar parte de su comunidade oral, gastrointestinal y cutánea. En la cesárea, son los microbios maternos de la piel los que llegan al bebé. «El nacimiento implica un cambio drástico para el neonato que pasa de un ambiente con reducida carga microbiana a un ambiente cargado de millones de microorganismos», detalla Jesús L. Romalde, profesor de microbiología de la Universidade de Santiago de Compostela (USC).
Uno de los factores de mayor peso en el desarrollo de la microbiota es el tipo de alimentación del recién nacido. «Numerosos trabajos han confirmado los beneficios a corto y largo plazo de la lactancia materna, frente al uso de fórmulas infantiles», añade el experto de la universidad gallega. La introducción de alimentos también conduce a «cambios significativos en la composición» y a una estabilización de los residentes, «con dominancia de grupos microbianos similares a los del adulto, aproximadamente a los dos o tres años», destaca el microbiólogo.
Estas primeras etapas de la vida se consideran críticas a la hora de ensamblar un buen microbioma, que se desarrolla a medida que lo hacen órganos como el cerebro. Eso sí, no todas las microbiotas siguen el mismo patrón o ritmo, sino que pueden seguir modificándose en mayor o menor medida. Influye la dieta —si es rica en fibra, frutas, verduras, legumbres y cereales integrales es beneficiosa—, la actividad física, el consumo de medicamentos, el estrés, la zona geográfica, el contacto con mascotas y hasta la gente con la que uno se relacione.

Mireia Vallès Colomer, directora del Grupo de Investigación sobre Microbioma de la Universidad Pompeu Fabra, señala que «cuánto más tiempo lleves viviendo con una persona, más se parecen los microbiomas porque mayor transmisión ha habido». Así, a nivel intestinal, los bebés comparten el 50 % de cepas con sus madres, «y a medida que van desarrollando actividades motoras, comparten menos con la progenitora y más con el círculo de personas con quien se relacionan», apunta. Esto se observa en el microbioma oral, por ejemplo, entre parejas o amigos, lo que hace pensar que la intestinal se obtiene, sobre todo, en el nacimiento, y las otras, a medida que pasan los años.
Posterior al asentamiento inicial, la adolescencia se considera otro período crucial «en el desarrollo de la microbiota debido a los cambios hormonales», resume Romalde. En la etapa adulta, la comunidad bacteriana del intestino tiende a ser estable, «salvo que se produzcan alteraciones debido a infecciones, tratamientos con antibióticos o cambios a largo plazo en la dieta o el entorno», apunta el experto de la USC.
Y, finalmente, la vejez. La edad avanzada conlleva un envejecimiento, y al igual que el corazón cumple años, también lo hace la microbiota. «El envejecimiento lleva asociados cambios fisiológicos como la inflamación crónica y la alteración del sistema inmunitario, que modifican el entorno intestinal, afectando la composición del microbioma», explica el profesor de la universidad gallega.
De esta forma, se vuelve menos diverso, sobre todo, a partir de los 60 o 65 años. En concreto, se ha observado una reducción en el número de bacterias beneficiosas, como las bifidobacterias, «y un incremento de las asociadas a la inflamación y las que no son buenas, como ciertos grupos de proteolíticas y bacteroides», apunta el especialista. Además, se reduce la producción de ácidos grasos de cadena corta, los cuales son ventajosos, «y un incremento de productos perjudiciales como el ácido láctico y el metano».
Una huella única
Si algo está claro en el mundo microscópico es que cada microbiota es única, como una huella dactilar invisible. El debate está en determinar hasta qué punto se parecen las de un individuo u otro. Lluansi precisa que esa semejanza puede llegar al 80 %, con diferencias en el 20 % restante. El microbiólogo Ignacio López Goñi, en cambio, rebaja la cifra hasta un 30 % de parecido, lo que implicaría un 70 % de diversidad.
Pero hay estudios que apuntan a un parecido todavía menor. En análisis realizados a personas que viven bajo el mismo techo se observó que la microbiota intestinal puede compartir entre un 10 y un 15 % de las cepas genéticas; mientras que la oral, hasta un 32 %.
Beneficios y futuro
La microbiota humana se ha llegado a etiquetar como el órgano oculto. Es más, en términos comparativos, se sabe que aporta más información que el genoma humano porque le supera en números: ocho millones de genes frente a 23.000, según el Human Microbiome Project. Pese a la mala fama de las bacterias, los microorganismos que viven en el cuerpo humano suelen ser beneficiosos o, al menos, neutrales, ya que establecen una relación de simbiosis: «Nosotros les proporcionamos espacio y nutrientes y ellos repercuten de manera positiva en nuestro organismo. Lejos de hacernos daño, si la microbiota está sana nos proporciona más beneficios que otra cosa», aclara Cisneros.
La composición de estas comunidades varía según la zona del cuerpo. A día de hoy, la intestinal se considera la más importante para la salud; también, la más poblada. Por su parte, la oral se divide en pequeños hábitats: saliva, lengua, superficies dentales, encías, mucosa bucal, paladar y placa subgingival/supragingival. Este lugar posee características físicas y químicas que modulan sus habitantes. Por ejemplo, los restos de alimentos que transporta la saliva sirven de comida para las bacterias, lo que contribuye a que estas se mantengan en niveles estables.
Las de la piel, también con nombre propio, pueden variar en función de la edad, sexo, estado del sistema inmunitario, entorno que le rodea, e incluso, el uso de medicamentos. A su vez, factores como la fricción, la humedad, el sebo o la exposición solar también son importantes. A medida que cambia su estado, más seca en unas zonas, grasa o húmeda en otras, cambia su composición microbiana.
La comunidad del tracto respiratorio es conocida por formar parte de la barrera de defensas y proteger a su huésped de infecciones patógenas. Su asentamiento se produce tanto por la interacción con otra microbiota, como por el entorno. Las infecciones locales o la toma de antibióticos.
Daniel Penela, investigador del grupo ya mencionado del Institut de Recerca Sant Joan de Déu, se centra en el estudio de la microbiota respiratoria, «una comunidad que cada vez va siendo más conocida». Su trabajo trata de buscar una relación entre infecciones respiratorias y las bacterias en edades pediátricas. «Hay niños que pueden tener una composición que les predisponga a que estas infecciones sean más graves», detalla. En este tipo, más allá de la colonización inicial que se produce en el nacimiento, «vacunar a los niños hace que la microbiota a nivel respiratoria también se module, de manera que crecen las bacterias que son protectoras y menguan las invasoras», añade el científico.
Finalmente, en el tracto urogenital femenino, el género Lactobacillus suele predominar en condiciones saludables. Estas bacterias acidifican el ambiente, lo que impide la colonización por patógenos nocivos. Cuando ese equilibrio se altera, pueden surgir infecciones como vaginosis, candidiasis, o cistitis.
Cuando se habla de sus posibilidades en la medicina, todos los profesionales consultados hablan del futuro. Las expectativas puestas en la microbiota están muy altas. López-Goñi considera que todavía «estamos en la edad de piedra». Cuando llegue la de oro, se podrá hablar de verdaderos avances: «Podemos pensar que dentro de veinte, treinta o cuarenta años, se podrá analizar nuestra microbiota y en función de ella, y de nuestro genoma, podrán diseñarnos un probiótico o un trasplante sintético de determinadas bacterias adecuadas para nuestras patologías», avanza.
Romalde asegura que esta comunidad «será clave» en la medicina de precisión, porque su estudio «permite personalizar los tratamientos, predecir respuestas a fármacos y desarrollar terapias dirigidas». El experto de la USC destaca que analizar la composición de la microbiota «ayuda a identificar biomarcadores de patologías, diseñar estrategias de estratificación de pacientes y crear terapias basadas en su modulación», aclara en referencia al uso de probióticos o trasplantes de microbiota fecal. Para el especialista, el conocimiento de estas comunidades abre la puerta al desarrollo de nuevos abordajes dirigidos a enfermedades en las que la microbiota resulte clave, «como el asma o la obesidad». El ejemplo práctico de su aplicación es el trasplante de microbiota fecal, eficaz en trastornos gastrointestinales.

Bacterias intestinales y neuronas, mundos que se entienden
El conocimiento disponible sobre la microbiota intestinal permite dibujar un universo aparte y conocer, en mayor profundidad, sus cuatro funciones: metabólica, protectora, inmunológica y comunicativa. Este conjunto es capaz de fermentar fibra que el intestino no puede degradar, de sintetizar la vitamina K o de producir ácidos grasos de cadenar corta, con propiedades antiinflamatorias. También evita la colonización de otros patógenos, entrena al sistema inmunitario desde el nacimiento, estimula la producción de linfocitos y anticuerpos, y refuerza la barrera intestinal. Además, favorece la comunicación con otros órganos, en especial, el cerebro.
Una relación que, aunque no se comprende al completo, deja pistas de cómo se produce. «El intestino recibe el nombre de segundo cerebro porque alberga más de 200 millones de neuronas, que forman el sistema nervioso entérico, que conviven con los miles de millones de bacterias que componen la microbiota intestinal», apunta Celia Herrera-Rincón, investigadora Ramón y Cajal en la Facultad de Ciencias Biológicas de la Universidad Complutense de Madrid, y autora de un estudio, recientemente publicado en Scientific Reports, que ha permitido dar un paso más allá en la neurociencia y el intestino.
Hasta el momento se pensaba que la comunicación entre microbiota y cerebro ocurría de manera indirecta, a través de moléculas químicas, mediadores del sistema inmune o nervio vago. Este nuevo artículo añade una pieza a este puzzle: la existencia de una comunicación directa e inmediata, «basada en el contacto físico entre bacterias y neuronas en el uso de señales bioeléctricas compartidas», que se considera el lenguaje universal de las células vivas.
El trabajo presenta un modelo experimental que permite observar interacciones en tiempo real entre neuronas de la corteza cerebral y Lactiplantibacillus plantarum, una bacteria común en alimentos fermentados y reconocida por su potencial probiótico.
Herrera describe este hallazgo como un cambio de paradigma en el eje microbiota-cerebro: «Nuestro trabajo aporta la primera evidencia experimental de que la comunicación entre bacterias y neuronas no tiene por qué limitarse a rutas indirectas, sino que puede ser también directa y bioeléctrica», destaca Herrera. En otras palabras, observaron que una bacteria viva puede cambiar la actividad de una neurona con solo tocarla. Así, vieron que este microorganismo «se adhiere a la superficie de las neuronas sin penetrarlas, y ese simple contacto basta para que las neuronas modifiquen su actividad eléctrica, su perfil molecular y transcriptómico», señala Herrera.
Esto significa que una vez que las neuronas detectan la presencia de una bacteria, activan programas específicos, «lo que demuestra que la interacción directa puede dejar una huella profunda tanto en la fisiología como en la expresión génica neuronal».
Dados los resultados obtenidos, la investigadora sospecha que este tipo de comunicación podría ser un lenguaje común en la mayoría de las bacterias: «Algunas probablemente lo utilicen para potenciar la actividad neuronal y otras para inhibirla. Lo realmente interesante será estudiar cómo responden las neuronas ante bacterias patógenas u oportunistas, y si esa interacción directa también puede contribuir a explicar ciertos trastornos neurológicos o del comportamiento», adelanta la investigadora.
El descubrimiento sienta las bases para explicar nuevas formas de cómo la microbiota modula la función cerebral y abre la puerta a tratamientos en el futuro: «Diseñar probióticos de nueva generación y terapias basadas en la bioelectricidad, con el objetivo, muy a largo plazo, de mejorar la salud mental y cognitiva», concluye la investigadora principal.
