Desvelan cómo los priones se replican para dar lugar al mal de las vacas locas o al de los ciervos zombies

SOCIEDAD
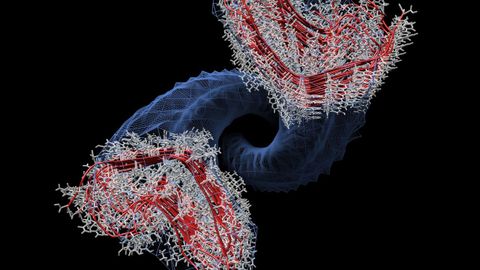
El hallazgo, con presencia gallega, abre la vía para tratar enfermedades degenerativas
13 jul 2019 . Actualizado a las 05:00 h.Una proteína mal plegada. En esencia eso es lo que es un prion, un agente infeccioso que cuando se acumula en el cerebro o en el sistema nervioso central dan lugar a enfermedades neurodegenerativas mortales denominadas encefalopatías espongiformes transmisibles, como la enfermedad de Creutzfeldt-Jacob o el insomnio familiar fatal en los seres humanos, o el mal de las vacas locas, el de los ciervos zombies o el scrapie en animales.
Muy poco se sabe, sin embargo, sobre cómo se desencadena la infección o, lo que es lo mismo, sobre la capacidad de los priones de hacer copias de sí mismos para avanzar y expandir el proceso de neurodegeneración. Y solo mediante este conocimiento básico se puede empezar a pensar en estrategias terapéuticas que bloqueen la acción de este tipo de proteínas, especialmente cundo la neurodegeneración afecta a los humanos. El paso que puede hacerlo posible parte de una investigación de las universidades de Santiago y Trento (Italia) que ha posibilitado la creación de un modelo computacional que revela los mecanismos de replicación de los priones. El trabajo se ha presentado en la revista científica Plos Pathogens.
«Generamos un modelo que creemos que es bastante realista y que nos permite entender cómo funciona la replicación de los priones para hacer copias de sí mismo. Es muy parecido a cómo se replica el ácido nucleico que permite la reproducción de los seres vivos, solo que este es un modelo perfecto, mientras que la replicación de los priones es mucho más chapucera. Sería como comparar una fotografía con un dibujo», explica Jesús Requena, investigador del Centro de Investigación de Medicina Molecular y Enfermedades Crónicas (Cimus) de la USC y coautor del trabajo.
«Por primera vez hemos reconstruido un mecanismo físicamente plausible de la replicación del prion», constata su colega italiano Giovanni Spagnolli.
A partir del modelo desarrollado, los investigadores han comprobado que el prion tiene forma de sacacorchos que constituye una espiral de cuatro pisos en la que los extremos son moldes, que son como una especie de lanzadores del proceso de replicación. «Es como un molde de hacer moldes», precisa Requena.
Y esta parte del prion podría ser el talón de Aquiles de este tipo de proteínas hacia el que enviar posibles agentes terapéuticos que anulen su acción. «Sabemos qué características tiene el molde y podríamos intentar bloquearlo con determinados productos que interrumpan el proceso», apunta el científico compostelano, quien también apunta que otra estrategia pasa por estabilizar el sustrato. De hecho, esta última alternativa ya se está probando en un ensayo clínico en Gran Bretaña.
En todo caso, el nuevo estudio aportará un mejor conocimiento para que los investigadores clínicos puedan descubrir alternativas terapéuticas para las enfermedades neurodegenerativas derivadas de un mal plegamiento y acumulación de las proteínas defectuosas. En estas patologías puede ocurrir que la infección sea transmitida de los animales a las personas, como ha ocurrido con las vacas locas y su variante humana de Creutzfeldt-Jacob. Pero esto no significa en absoluto que en todos los casos se produzca este trasvase.

Por ejemplo, en el caso de los ciervos zombies todas las pruebas realizadas hasta el momento revelan que no existe una transmisión a los seres humanos. «Pero tampoco habría que bajar la guardia porque podría ocurrir una mutación», advierte el investigador Jesús Requena.
